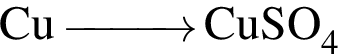
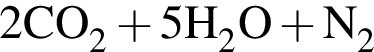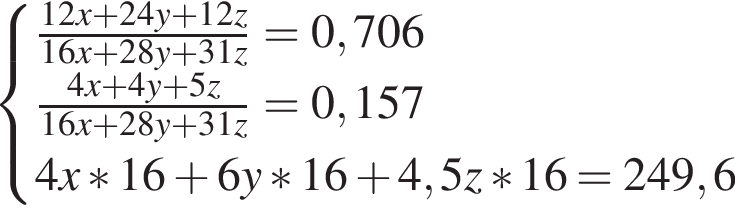Одноатомными молекулами (н. у.) образовано простое вещество:
Число нейтронов в составе атома ![]() равно:
равно:
Электронная конфигурация 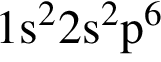 соответствует иону или атому в основном состоянии:
соответствует иону или атому в основном состоянии:
Высшему оксиду элемента, порядковый номер которого 33, соответствует гидроксид состава:

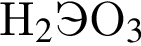

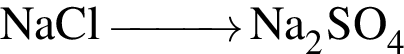
Ионная связь имеется во всех веществах ряда:
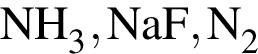
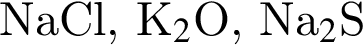
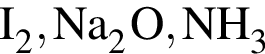
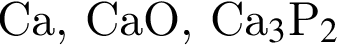
В кристалле Mg(NO3)2 присутствуют связи:
В атоме химического элемента ![]() в основном состоянии электроны распределены по энергетическим уровням следующим образом: 2, 8, 18, 6. Степень окисления
в основном состоянии электроны распределены по энергетическим уровням следующим образом: 2, 8, 18, 6. Степень окисления ![]() в высшем оксиде равна:
в высшем оксиде равна:
Основная соль может образоваться при взаимодействии соляной кислоты с каждым из гидроксидов, формулы которых:
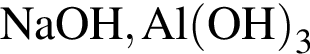
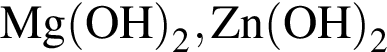
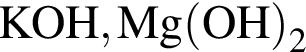
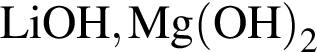
Два кислотных оксида образуются в результате химического превращения:
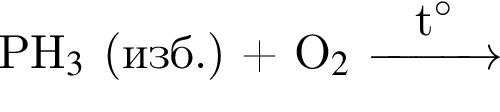 ;
;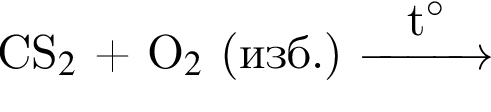 ;
;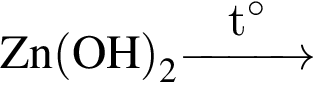 ;
;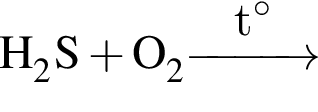 .
.Гидроксид натрия в разбавленном водном растворе реагирует (20 °C) со всеми веществами ряда:
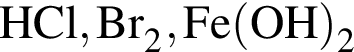
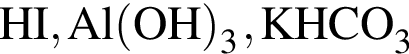
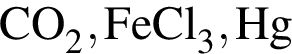
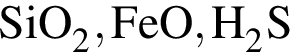
Твёрдый гидроксид натрия целесообразно использовать для осушения влажного газа:
Газ выделяется при добавлении избытка разбавленной серной кислоты к веществам:
а) ![]()
б) ![]()
в) ![]()
г) ![]()
Используя в качестве реагента только разбавленную серную кислоту, в одну стадию можно осуществить превращение:


Относительно вещества, формула которого 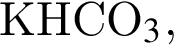 верно:
верно:
а — в водном растворе реагирует с углекислым газом
б — взаимодействует с раствором уксусной кислоты
в — относится к средним солям
г — при его разложении образуется карбонат калия
Реагируют с концентрированной серной кислотой, но НЕ реагируют с разбавленной серной кислотой оба вещества пары:
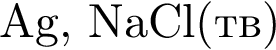
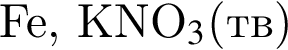
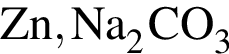
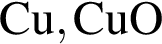
Оксид фосфора(V) проявляет кислотные свойства, реагируя с веществами:
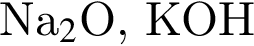
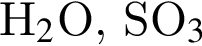
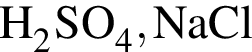
При пропускании углекислого газа через четыре пробирки с растворами веществ в двух из них наблюдалось помутнение растворов. В этих двух пробирках находились вещества:
а) 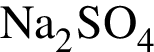
б) 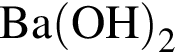
в) 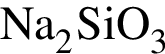
г) 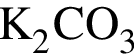
Выберите правильное утверждение:
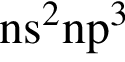
Аммиак является одним из продуктов реакции, схема которой:
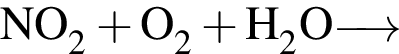
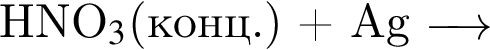
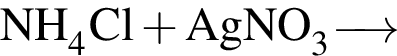
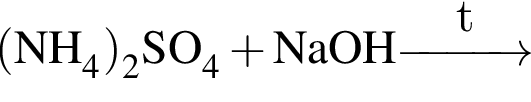
В отличие от воды разбавленный водный раствор гидроксида калия растворяет:
а) ![]()
б) ![]()
в) ![]()
г) ![]()
В результате взаимодействия водорода с фтором в соответствии с термохимическим уравнением
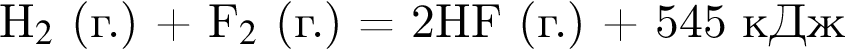
получен фтороводород массой 32 г. Количество теплоты (кДж), которая выделилась при этом, равно:
![]() водного раствора уменьшается при:
водного раствора уменьшается при:
В сосуде объемом 2 дм3 протекает реакция 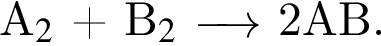 Через 4 с после начала реакции образовалось вещество
Через 4 с после начала реакции образовалось вещество ![]() химическим количеством 12 моль. Средняя скорость (моль/дм3 · с) образования вещества
химическим количеством 12 моль. Средняя скорость (моль/дм3 · с) образования вещества ![]() равна:
равна:
Окислительно-восстановительной реакцией является реакция, схема которой:
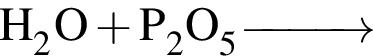
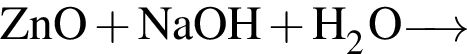
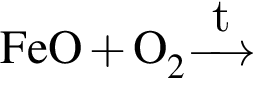
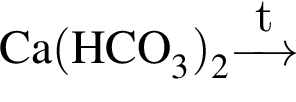
При добавлении оксида лития к воде, содержащей фенолфталеин, в растворе:
а) увеличивается ![]()
б) увеличивается концентрация ионов ![]()
в) изменяется окраска
г) уменьшается ![]()
Выберите схему практически осуществимой реакции (указаны все исходные вещества и продукты реакций без коэффициентов):

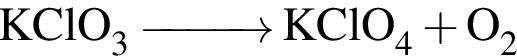
Укажите формулу соединения, которое вступает в реакции поликонденсации:
Назовите по систематической номенклатуре соединение, формула которого:
При действии хлора на бутадиен-1,3 НЕ образуется:
Дана схема превращений 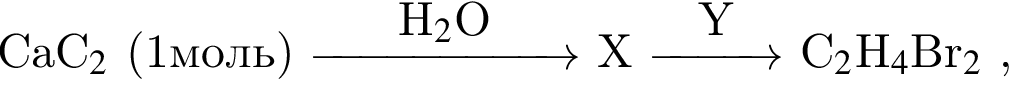 где Х и Y соответственно:
где Х и Y соответственно:
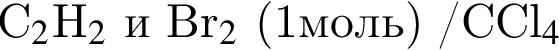
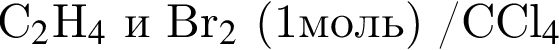
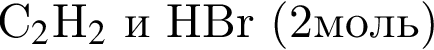
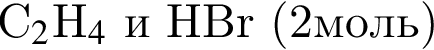
В результате реакции 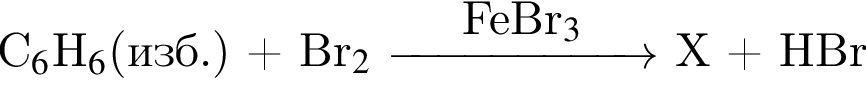
получен бромоводород количеством 0,7 моль. Масса (г) органического продукта Х составляет:
В порядке увеличения температур кипения вещества расположены в ряду:
Ацетальдегид является продуктом реакции, схема которой:
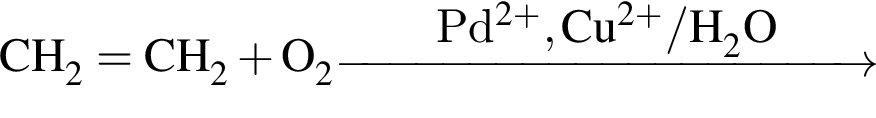
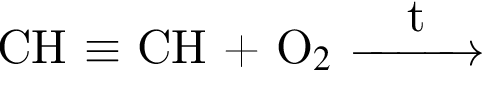
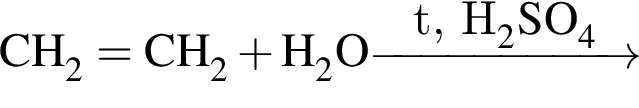
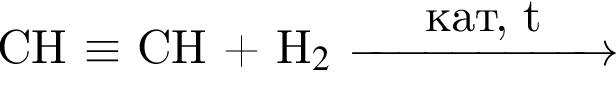
Альдегид образуется по схеме:
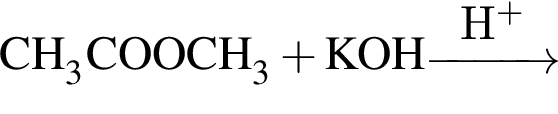
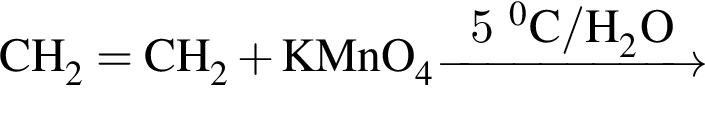
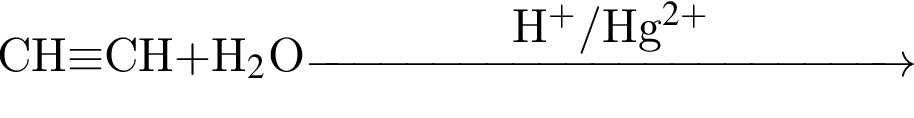
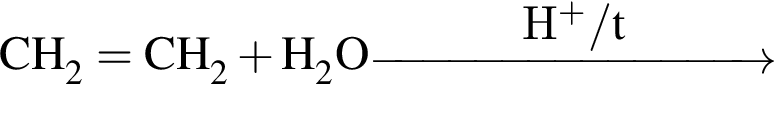
Органическое вещество X2, полученное в результате превращений
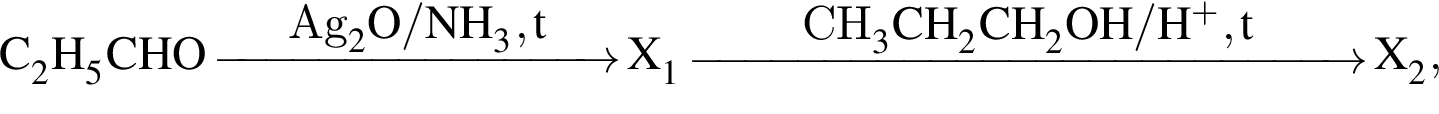
гидролизовали избытком раствора гидроксида натрия. Продуктами гидролиза являются:
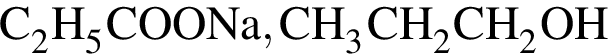
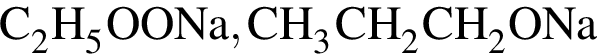
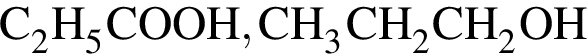
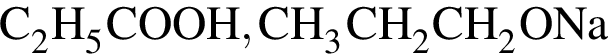
Укажите сумму коэффициентов перед формулами продуктов в уравнении реакции взаимодействия сложного эфира с избытком раствора ![]()
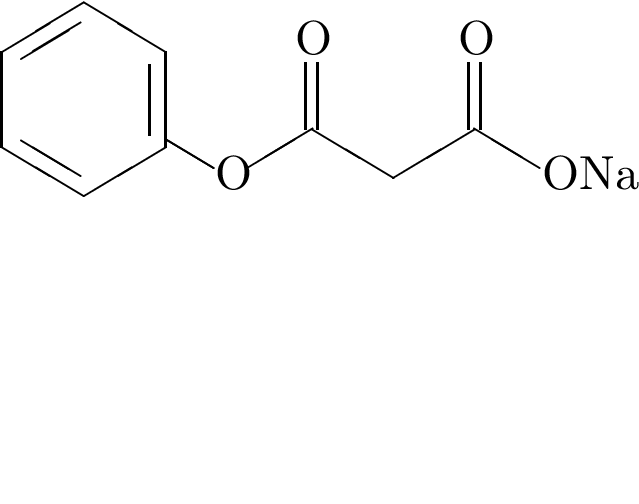
Число пептидных связей в молекуле
равно:
Относительная молекулярная масса одной макромолекулы полибутадиена составляет 18 900. Степень полимеризации равна:
Аминоуксусная кислота взаимодействует с веществами, формулы которых (электролиты взяты в виде водных растворов):
а) ![]()
б) ![]()
в) ![]()
г) ![]()
1) а,в; 2) а, б; 3) в, г; 4) б, г.
Выберите утверждения, справедливые для этанола:
1) вытесняет угольную кислоту из водного раствора карбоната натрия
2) водный раствор НЕ изменяет окраску индикаторов
3) при взаимодействии с натрием образуется этаноат натрия и водород
4) при окислении может быть получена уксусная кислота
5) при взаимодействии с бромоводородом образуется бромэтан и вода
6) в лаборатории получают реакцией щелочного гидролиза жиров
Ответ запишите в виде последовательности цифр в порядке возрастания, например: 135.
Определите коэффициент перед формулой продукта окисления в уравнении химической реакции, протекающей по схеме
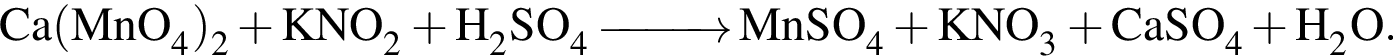
Смесь алканов подвергли пиролизу. В результате образовалась смесь этена, пропена и водорода с массовой долей водорода 1,80%. Вычислите молярную массу (г/моль) исходной смести алканов.
В четырех пронумерованных пробирках находятся органические вещества.
О них известно следующее:
— вещества в пробирках № 1 и № 2 смешиваются с водой в любых соотношениях;
— вещества в пробирках № 3 и № 4 — жидкости, не смешивающиеся с водой (20 °C);
— содержимое пробирки № 2 реагирует с 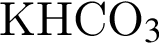 с выделением газа;
с выделением газа;
— вещество в пробирке № 3 в присутствии ![]() реагирует с хлором.
реагирует с хлором.
Установите соответствие между названием органического вещества и номером пробирки, в которой находится указанное вещество.
А) гексан
Б) глицерин
В) бензол
Г) уксусная кислота
1
2
3
4
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4B2ГЗ.
Установите последовательность реагентов, с помощью которых целесообразно осуществлять превращения по схеме
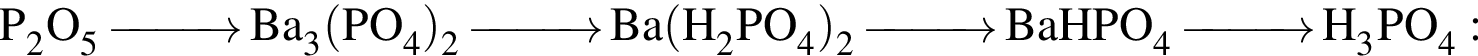
1) серная кислота
2) вода
3) кислород
4) оксид бария
Ответ запишите цифрами в порядке следования превращений, например: 1224.
Плотность по неону паров хлорида и фторида одного итого же химического элемента равна 8,3 и 5,0 соответственно. В хлориде и фториде этот элемент находится в одинаковой степени окисления. Найдите степень окисления элемента в данных галогенидах.
Ответ запишите одной цифрой, например: 5.
Уксусный ангидрид 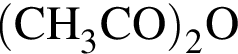 легко взаимодействует с водой, образуя уксусную кислоту:
легко взаимодействует с водой, образуя уксусную кислоту:
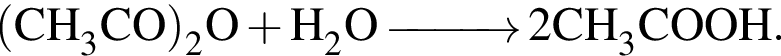
Какой объем (см3) водного раствора уксусной кислоты с массовой долей 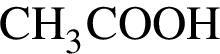 90% (
90% (![]() = 1,06 г/см3) следует добавить к 120 г раствора уксусного ангидрида в уксусной кислоте с массовой долей
= 1,06 г/см3) следует добавить к 120 г раствора уксусного ангидрида в уксусной кислоте с массовой долей 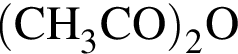 45%, чтобы получить 20-процентный раствор уксусного ангидрида?
45%, чтобы получить 20-процентный раствор уксусного ангидрида?
Загрязненный образец соли 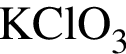 массой 22,28 г нагрели в присутствии катализатора до постоянной массы. При этом соль разложилась на хлорид калия и кислород, а масса образца уменьшилась на 7,68 г. Известно, что при нагревании не образовалось никаких посторонних веществ, а примеси не разлагались и не улетучивались. Вычислите массовую долю (%)
массой 22,28 г нагрели в присутствии катализатора до постоянной массы. При этом соль разложилась на хлорид калия и кислород, а масса образца уменьшилась на 7,68 г. Известно, что при нагревании не образовалось никаких посторонних веществ, а примеси не разлагались и не улетучивались. Вычислите массовую долю (%) 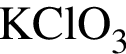 в исходном образце.
в исходном образце.
Смесь алкина и сероводорода в мольном отношении 1 : 3 сожгли в избытке кислорода. Продукты сгорания поглотили избытком раствора гидроксида кальция. Действием окислителя на выпавший осадок весь сульфит кальция перевели в сульфат кальция. Масса полученного в результате осадка (сульфат и карбонат кальция) составила 40,4 г. При действии на этот осадок избытка соляной кислоты образуется 4,48 дм3 (н. у.) газа. Укажите молярную массу (г/моль) алкина.
Для полного гидрирования газообразной смеси ациклических углеводородов (относительная плотность по аргону 1,35) необходим водород, объем которого вдвое больше объема смеси. Рассчитайте, какой объем (дм3) кислорода требуется для полного сгорания исходной смеси углеводородов массой 216 г (все объемы измерены при нормальных условиях).
В смеси, состоящей из этена, метиламина и метана, массовые доли водорода и азота равны 15,7% и 13,7% соответственно. Вычислите максимальную массу (г) такой смеси, которую можно окислить газовой смесью массой 329,6 г, состоящей из озона и кислорода. Продуктами реакции являются только 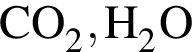 и
и ![]()

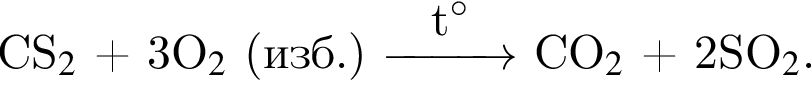
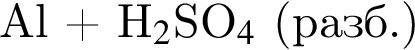 →
→ 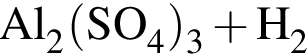 ↑
↑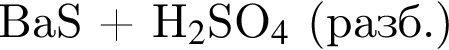 →
→ 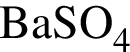 ↓ +
↓ + 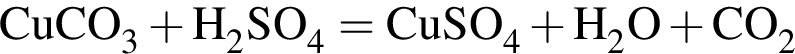 ↑
↑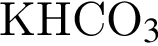 не взаимодействует с углекислым газом, являясь кислой солью.
не взаимодействует с углекислым газом, являясь кислой солью.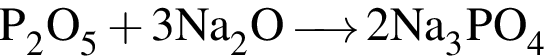 .
.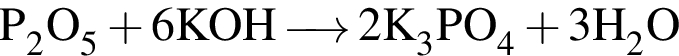 .
.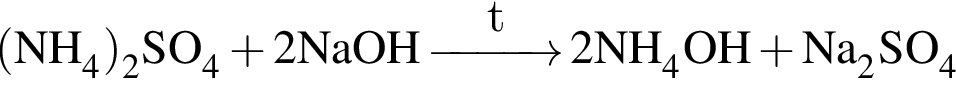
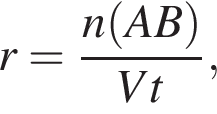 где r — скорость реакции, n(AB) — химическое количество, V — объем, t — время реакции. Находим:
где r — скорость реакции, n(AB) — химическое количество, V — объем, t — время реакции. Находим: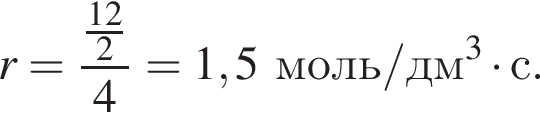
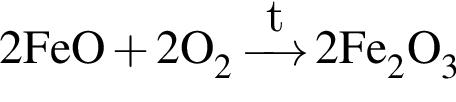
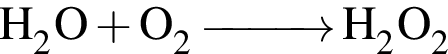
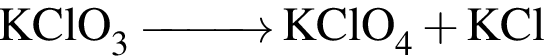
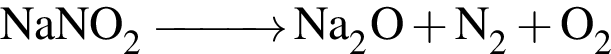
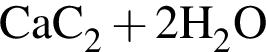 →
→ 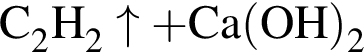
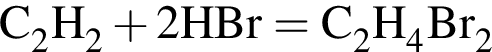
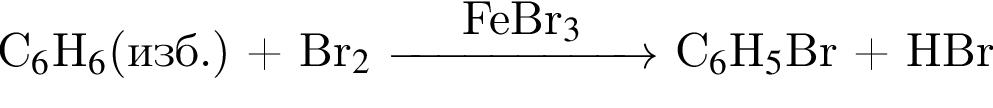
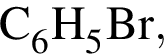 учитывая стехиометрические коэффициенты уравнения реакции, очевидно, что:
учитывая стехиометрические коэффициенты уравнения реакции, очевидно, что:

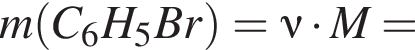
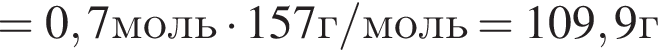
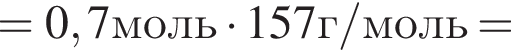

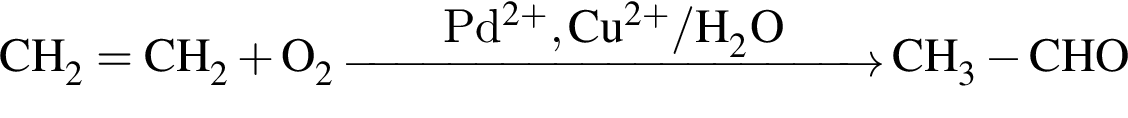
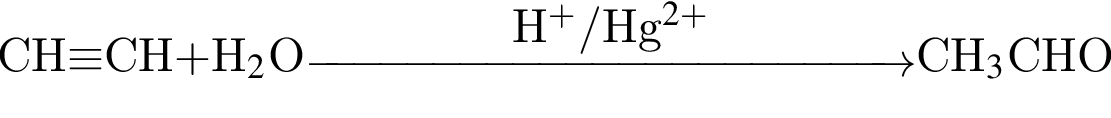
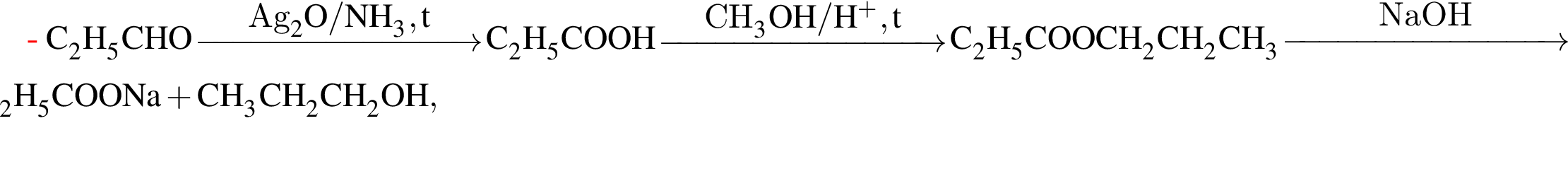
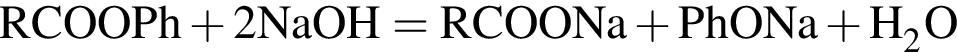

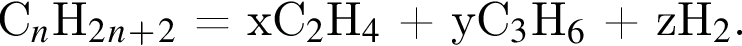
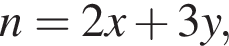 число атомов водорода
число атомов водорода 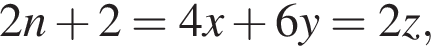 получим
получим 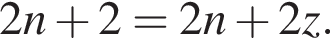 Значит, z = 1.
Значит, z = 1.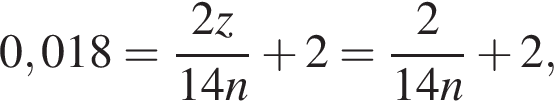
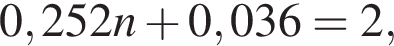 откуда n = 7,79 — среднее значение.
откуда n = 7,79 — среднее значение.




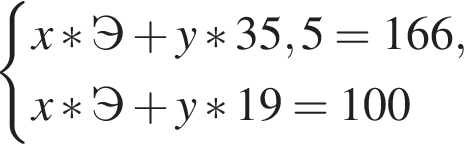 Решением данной системы будет являться
Решением данной системы будет являться  Таким образом, под данный значения подходят следующие соединения:
Таким образом, под данный значения подходят следующие соединения: 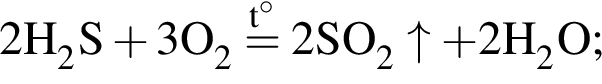
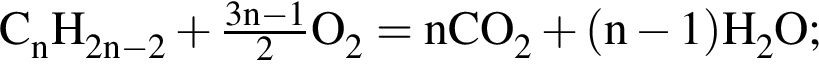
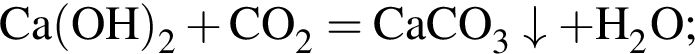
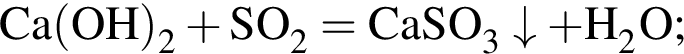
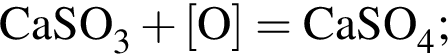
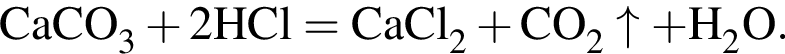
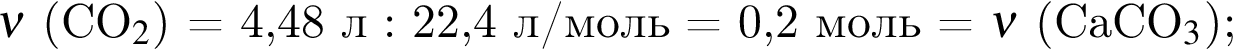
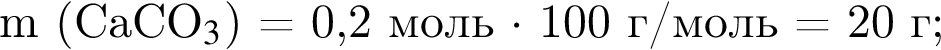
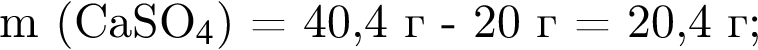
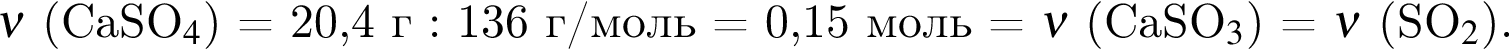
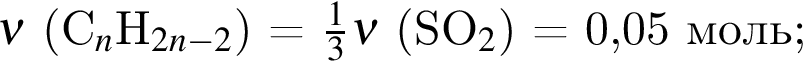
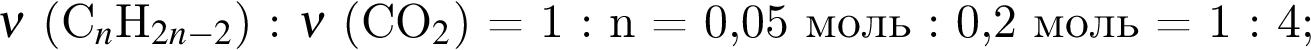

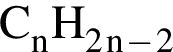 . Откуда n находим: 14n−2 = 54, n = 4. Схема реакции горения будет тогда иметь вид:
. Откуда n находим: 14n−2 = 54, n = 4. Схема реакции горения будет тогда иметь вид:  . nсмеси=216/54 = 4 моль. nO2=4 · 5,5 = 22 моль. VO2 = 22 · 22,4 = 493 л или 493 дм3.
. nсмеси=216/54 = 4 моль. nO2=4 · 5,5 = 22 моль. VO2 = 22 · 22,4 = 493 л или 493 дм3. →
→ 
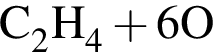 →
→ 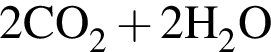
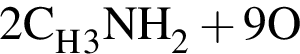 →
→